סרטן השד
סרטן השד הוא מחלה סרטנית שמקורה בשד, אך היא עלולה לשלוח גרורות אל איברים שונים בגוף. בשלביה הראשוניים המחלה מתאפיינת בגושים לא כואבים בשד, לאחר מכן חודרים תאים סרטניים לקשרי הלימפה של בית השחי ומשם עלולים התאים לחדור לזרם הדם ודרכו להגיע לאיברים מרוחקים כגון הכבד, הריאות והמוח. המחלה מתפתחת בעיקר בנשים מעל גיל חמישים והיא נדירה בגברים ונשים צעירות. הסוג הנפוץ של סרטן השד הוא קרצינומה, אך קיימים סוגים נדירים יותר של סרטן השד המסווגים כסרקומה או לימפומה.
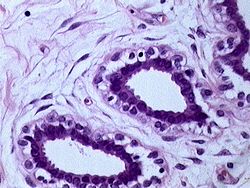
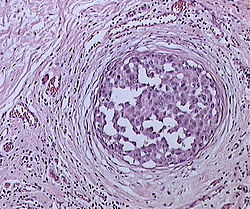
מקורו של סרטן השד מסוג קרצינומה הוא ברקמה המצפה את צינורות ובלוטות החלב שבשד. בשלבי המחלה המוקדמים תאי האפיתל ממלאים את חלל צינוריות החלב, בהמשך חודרים תאי האפיתל את דופן צינור החלב ופולשים לרקמה התומכת. גוש התאים שנוצר (הגידול הראשוני) יכול לחדור את דופן בית החזה או את העור. מן הגידול הראשוני יכולים להתנתק תאים ליצירת גרורות.
העובדה שהשד אינו מהווה איבר חיוני לשרידות החולה מאפשרת לכרות את הגידול הראשוני ללא נזק למערכות הגוף, כך שגידול זה כשלעצמו אינו מהווה בדרך כלל סכנת חיים. הסכנה העיקרית בסרטן השד היא היווצרות גרורות באיברים החיוניים שאינם מאפשרים הוצאה בניתוח.
תוכן עניינים
אפידמיולוגיה
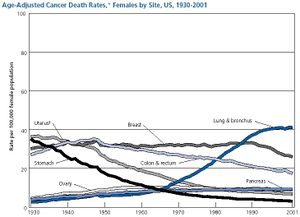
סרטן השד הוא המחלה הממאירה השכיחה ביותר בקרב נשים בעולם המערבי. בארצות הברית אובחנה המחלה בשנת 2005 בלמעלה מ-210 אלף חולים חדשים (מתוכם פחות מאלפיים גברים). בנוסף, בכ-60 אלף נשים אובחנה DCIS (נגעים טרום סרטנים, ראו להלן- שלב 0). בשנה זאת נפטרו מן המחלה כ-40 אלף חולים (מתוכם כ-400 גברים).
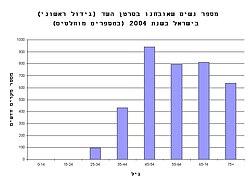
בישראל, על פי נתוני הלשכה המרכזית לסטטיסטיקה לשנת 2004, אובחנו 93 חולות חדשות בסרטן השד לכל 100,000 נשים. באותה שנה נפטרו מן המחלה 28 נשים לכל 100,000 נשים. בסך הכול, מדי שנה נפטרות בישראל קרוב ל-1,000 חולות עקב המחלה.
כפי שניתן לראות מן הגרף, המחלה שכיחה בעיקר בנשים מעל גיל 45. רובן של הנשים המאובחנות בסרטן השד אינן משתיכות לקבוצת סיכון מובהקת פרט להיותן נשים הגיל האל-וסת או לקראת גיל האל-וסת. עם זאת, נמצאו מספר קבוצות סיכון שמגבירות באופן משמעותי את השכיחות לסרטן השד:
- נשים הנושאות פגם גנטי בגנים המקודדים לחלבון BRCA1 או BRCA2 הן בעלות סיכון של 85% לחלות בימי חייהן בסרטן השד או השחלה. מכיוון שגנים אלו הם דומיננטים, דרוש רק עותק אחד של הגן מהאב או האם על מנת שהפגם יופיע בצאצא. כמו כן, נשים שלהן היסטוריה משפחתית של מחלת הסרטן נמצאות בסיכון גבוה יותר ללקות במחלה גם אם אין במשפחתן פגם גנטי בBRCA1 או BRCA2. מאחר שגנים אלו הם אוטוזומלים , הם עוברים בתורשה מאב ומאם באותה תדירות.
- עישון מעלה את הסיכון ללקות בסרטן השד.
- השמנת יתר מעלה את הסיכון ללקות בסרטן השד.
- חשיפה לאסטרוגן מעלה באופן משמעותי את הסיכוי לסרטן השד, מכיוון הגוף נחשף לאסטרוגן במהלך המחזור החודשי או בטיפולים הורמונלים הכוללים אסטרוגן:
- מספר רב של מחזורים כתוצאה מווסת מוקדמת או אל-וסת מאוחרת.
- אי כניסה להריון עד גיל 30, הריונות מועטים ואי-הנקה.
- נטילת גלולות למניעת הריון (ביחוד גלולת המכילות כמות גדולה של אסטרוגן).
- טיפול הורמונלי חליפי (HRT) לאחר גיל האל-וסת.
- צפיפות ברקמת השד מגדילה את הסיכון ללקות בסרטן השד, ומקשה על אבחון ראשוני בעזרת ממוגרפיה.
שלבי המחלה
מקובל לזהות שלבים בהתפתחות סרטן השד, באופן דומה למחלות סרטניות אחרות:
- שלב 0: השלב הפרה-סרטני - מצב שבו תאי האפיתל המצפים את צינורות החלב שבשד חודרים אל תוך הצינור וסותמים אותו (DCIS) Ductal Carcinoma in situ, גידול זה אינו שולח גרורות בדרך כלל, אך מהווה סכנה פוטנציאלית.
- שלב 1: התאים הסרטניים יוצאים מצינורות החלב- IDC (Infiltrating Duct Carcinoma), או מבלוטות החלב (ILC) ופולשים אל הרקמה התומכת. כך הופך הגידול לגידול פולשני. כל עוד הגידול בגודל של עד 2 ס"מ, ואינו פולש לנודיות הלימפה ואינו דלקתי הוא מוגדר כשלב 1.
- שלב 2:
- חדירה של תאים סרטניים לנודיות הלימפה הסמוכות לגידול הראשוני.
- גידול ראשוני בגודל של בין 2 ס"מ ל-5 ס"מ שלא חדר למערכת הלימפה.
- שלב 3:
- גידול ראשוני גדול מ-5 סנטימטר וגרורות במערכת הלימפה מאבדות את צורתן.
- גרורות באזורים הקרובים לשד כגון קישרי הלימפה בבית השחי, הצלעות ושרירי החזה.
- גידול ראשוני חודר את השד לכיוון בית החזה או ההעור.
- גידול ראשוני דלקתי.
- שלב 4:
- גרורות סרטניות נמצאות באיברים מרוחקים מן השד כמו המוח, הכבד והעצמות.
הערכת שלבי המחלה יכולה להעשות רק לאחר הוצאת הגידול הראשוני. ההערכה נעשית על ידי פתולוג בשיטות היסטולוגיות, ואיתור גרורות נעשה בעזרת מיפוי עצמות ו-MRI.
אבחון המחלה
בדיקה עצמית ובדיקת רופא
היות וגילוי המחלה בשלביה המוקדמים מוריד באופן משמעותי את הסיכוי לתמותה מן המחלה, מומלץ לבצע בדיקת שד עצמית אחת למספר שבועות ובדיקה שנתית על ידי רופא גינקולוגיה או כירורג. בבדיקה יש לחפש סימנים חשודים המעידים על אפשרות של התפתחות סרטנית. סימנים אלה כוללים שינוי צורה באחד מהשדיים, הופעת גומות או בליטות, הופעת כלי דם, תזוזת הפטמה או הפרשות ממנה. בנוסף, על ידי מישוש ניתן לחוש בגושים בשד או בבית השחי.
אבחון על ידי הדמיה
הסימנים הראשונים למחלה מתגלים לרוב בבדיקת ממוגרפיה - צילום רנטגן של השד. בניגוד לצילומי רנטגן רפואיים אחרים, ממוגרפיה נעשית תוך כדי לחץ פיזי על השד, לחץ שתפקידו לשטח את השד על מנת להגדיל את השטח המצולם. בתצלום הממוגרפיה ניתן להבחין בגושים, בהסתיידויות, בצפיפות שד לא-טיפוסית או בשינויים שחלו בשד ביחס לשנים קודמות. בישראל מומלצת בדיקת ממוגרפיה אחת לשנה או שנתיים בכל הנשים מעל גיל חמישים, ולנשים בסיכון גבוה מומלץ על ממוגרפיה החל מגיל 35. הדעות חלוקות לגבי התועלת שבבדיקת ממוגרפיה שנתית החל מגיל 40 לכלל הנשים, אך נמצא כי אבחון מוקדם של המחלה בדרך של ממוגרפיה מוריד את התמותה מסרטן השד ב-30%.
בנשים צעירות או בנשים הנוטלות הורמונים (טיפול הורמונלי חילופי) רקמת השד צפופה, ועל כן אינה מאפשרת אבחון של ממצאים חשודים בממוגרפיה. לפיכך, במקרים אלה יש להשתמש בבדיקה המבוססת על גלי אולטרסאונד. במהלך גיל האל-וסת יורדת צפיפות השד עם החלפת הרקמה הפיברוגנלדולרית ברקמת שומן ענייה בכלי דם, דבר המאפשר את בדיקת הממוגרפיה.
מבחינה אבחנתית, בדיקת אולטרסאונד נחשבת נחותה מן הממוגרפיה, בין השאר משום שהיא אינה מאתרת הסתיידות - אחד הממצאים המצביעים על חשד לתהליך סרטני. בדיקת האולטרסאונד נחוצה, כאמור, בנשים בעלות מרקם שד צפוף. בנוסף משמש האולטרסאונד לאבחון מדויק יותר של גושים וציסטות שהתקבלו בממוגרפיה.
ביופסיה
לאחר שאובחן ממצא חשוד בממוגרפיה או בבדיקה ידנית בידי כירורג שד, יש לבחון את הרקמה החשודה בעזרת ביופסיה. ביופסיה מבוססת על דיקור האזור החשוד והוצאת פיסת רקמה מתוכו. בהתאם לסוג הגידול יש לבחור את קוטר המחט שתשמש לדיקור, ובהתאם לכך את סוג ההרדמה בעת הביופסיה - מקומית או כללית. הדוגמה נשלחת לבדיקה היסטולוגית של פתולוג, ובמקרה שהפתולוג איבחן את הגידול כסרטני מומלץ לבצע בדיקה אימונוהיסטוכימית לקולטני הורמונים ול-HER-2. בישראל נהוג לבצע את הניתוח לטיפול בסרטן השד ימים אחדים לאחר שנתקבלו תוצאות הביופסיה.
פרוגנוזה
מדד שרידות
המדד המקובל לפרוגנוזה הוא שרידות ל-5 שנים. חשוב לציין שמדד זה לוקה במספר חסרים: ראשית, תיתכן תמותה או חזרה של המחלה אחרי יותר מ-5 שנים; שנית, נתונים אלה אינם משקפים את ההתפתחות שחלה בתרופות בשנים האחרונות, כלומר היום השרידות היא ככל הנראה גבוהה יותר.
| שלב 0 | 100% |
| שלב 1 | 98% |
| שלב 2 | 88%-76% |
| שלב 3 | 56%-49% |
| שלב 4 | 16% |
| מקור: American Cancer Society הנתונים מתאריך 9/04 | |
גורמים המשפיעים על הפרוגנוזה
- ככל שהמחלה נמצאת בשלב מוקדם יותר, הפרוגנוזה טובה יותר.
- בחורות צעירות, (בנות 35 ופחות), המחלה נוטה להיות קטלנית יותר.
- פרוגנוזה גרועה לחולות שסבלו בעבר מסרטן אחר.
- בגברים, סרטן השד נדיר מאוד, אך סיכויי ההחלמה קטנים מאשר סרטן השד בנשים.
סמנים מולקולריים המשפיעים על הפרוגנוזה
בשנים האחרונות נמצאו מספר סמנים המאפשרים לחזות באופן טוב יותר את מהלך המחלה, סמנים אלו הם לרוב חלבונים המבוטאים בתאים הסרטניים או בסביבתם.
- נשים שמחלתם תורשתית ונובעת מפגם בגן BRCA-1 או BRCA-2 נוטות לפיתוח מחלה בגיל צעיר, וכן לחלות בסרטן שחלות.
- ביטוי של רצפטורים לאסטרוגן (estrogen receptor alpha) ולפרוגסטרון על התא הם אינדיקטורים לפרוגנוזה טובה, בין היתר משום שהוא מאפשר קבלת תרפיה הורמונלית.
- ביטוי של חלבונים ממשפחת ErbB - בייחוד ErbB-2 (הידוע גם כ HER-2) ו- ErbB-1 או EGFR על ממברנת התא ו/או ממברנת הגרעין, הוא אינדיקטור לפרוגנוזה פחות טובה. ייתכן ובעתיד, כאשר תכנס תרופת ההרצפטין (המיועדת נגד ErbB-2) לשימוש מניעתי, תפחת הפרוגנוזה הרעה של החלבון.
- ביטוי של כמוקינים כגון (MCP-1 (CCL2 הוא אינדיקטור לפרוגנוזה גרועה.
- הימצאות החלבון p53 בגרעין היא אינדיקטור טוב.
- הימצאות mucin 1 במחזור הדם היא אינדיקטור לגרורות.
- הימצאות החלבון COX-2 או תוצרו פרוסטגלנדין E מעידה על פרוגנוזה גרועה.
- חדירה לגידול של תאי דם לבנים, בעיקר מונוציטים ולימפוציטים מסוג תאי T רגולטוריים או תאי T עוזרים - מעידה על פרוגנוזה גרועה. לעומת זאת חדירה של תאי T ציטוטוקסיים היא סמן לפרוגנוזה טובה.
- Nuclear grade (שלמות הגרעין) - מעיד על מצב הכרומטין שבגרעין - Low-grade משמעותו שהכרומטין מפוזר ברובו בגרעין ואינו מתחלק. high- grade הכרומטין מרוכז בכרומוזומים, והתא מתחלק במהירות (מעיד על פרוגנוזה גרועה).
דרכי טיפול בסרטן השד למטרת ריפוי
מבין המחלות הממאירות, סרטן השד היא המחלה בעלת האופציות הטיפוליות הרבות ביותר. התאמת טיפול לחולה נעשית בהתבסס על קריטריונים שונים ובכללם שלב המחלה, גיל החולה, התמיינות היסטולוגית של הרקמה הסרטנית, היסטוריה משפחתית של סרטן השד וביטוי חלבונים שונים בתאים הסרטניים.
חולות שאובחנו במחלה בשלב 0 נכנסות לרוב למשטר של מעקב או טיפול אנדוקריני. בחולות בעלות היסטוריה משפחתית (מוטציה בגן BRCA1 או BRCA2) יש לשקול התערבות ניתוחית, לעתים עד כדי כריתת שד רדיקלית. בחולות שאובחנו בשלבים מוקדמים של המחלה - שלב 1 או 2 - יש להסיר את הגידול הממאיר ואת בלוטות הלימפה הנגועות באופן כירורגי. כדי להוריד את הסיכוי לחזרת המחלה יש לשקול מתן טיפול משלים (Adjuvant): הורמונלי, כימותרפי ואם החולה מבטאת HER-2 גם הרצפטין. בחולות שבהן התגלתה מחלה מקומית מתקדמת (שלב 3) שבה לא ניתן להוציא את הגידול כולו, נהוג להתחיל בטיפול כימותרפי ואנדוקריני מקדים (טיפול Neo adjuvant) לפני הטיפול הניתוחי, בתקווה שהטיפול הכימותרפי יצמצם את ממדי הגידול ויאפשר את הסרתו. חולות אלו יפיקו תועלת גם מטיפולי הקרנה באזור החזה. חולות בהן התגלתה מחלה גרורתית (שלב 4) מטופלות לרוב בדרך של כימותרפיה, טיפול אנדוקריני, הקרנה לאיברים הנגועים בגרורות. לעתים יש צורך בהתערבות ניתוחית להוצאת גרורות, אך לרוב אין תועלת בניתוח השד להוצאת הגידול הראשוני.
התערבות ניתוחית
יש יתרון רפואי בהוצאת הגידול הראשוני על ידי ניתוח בכל שלב של סרטן השד לפני הופעת גרורות מרוחקות. דרך הוצאת הגידול שנויה במחלוקת מעל ל-100 שנה - הגישה הרדיקלית גורסת כי כריתת השד כולו תקטין את הסיכוי לחזרת המחלה, ולעומתה הגישה השמרנית גורסת כי על ידי כריתה חלקית של השד ניתן למנוע את הישנות המחלה באותה מידה.
הגישה הרדיקלית
- כריתת שד רדיקלית ממותנת (modified radical mastectomy) - ניתוח שבו מוצאת כל רקמת השד ואיתה תוכן בית השחי. ניתוח זה משמש כיום כתקן, שאל יעילותו מושווים שאר הניתוחים. גבולו העליון של האזור המנותח הוא עצם הבריח, גבולו התחתון חיתולית (fascia) שריר הבטן, וגבולו הקדמי שריר הליטמוס הגבי. לאחר שחרורו מורם השד משריר הפקטורליס הגדול (Pectoralis Major) ביחד עם החיתולית המקיפה אותו. בשלב הכריתה האחרון מוצא תוכן בית השחי. חשיבות רבה יש להוצאת בלוטת הלימפה של בית השחי, הממלאת תפקיד חשוב בתהליך יצירת הגרורות. הניתוח מתאים לחולות בשלבים 1 ו-2, והוא הניתוח האפשרי היחיד בחולות שאובחנו בשלב 3 ושגידולן לא צומצם בעקבות הטיפול המקדים. בחולות שסווגו כשלב 3 יש יתרון בהקרנת מיטת השד לאחר ניתוח רדיקלי.
- כריתת שד פשוטה (simple mastectomy) - הליך דומה לכריתה רדיקלית ממותנת, אך ללא כריתת תוכן בית השחי. הניתוח מבוצע בחולות קשישות שאינן מקבלות טיפול משלים, או בנשים שאובחנו ב-DCIS.
הגישה השמרנית
בניגוד לגישה הרדיקלית הגורסת כי מוטב לכרות את השד כולו, הגישה השמרנית מבקשת לשמר ככל הניתן את השד כדי למנוע את הסבל והסיבוכים הכרוכים בניתוח רדיקלי. לגישה השמרנית שתי שיטות ניתוח - ניתוח כריתת רביע וניתוח למפקטומי. בשני המקרים מוצא הגידול הסרטני ואיתו שולי הרקמה הבריאה, ובנוסף נבתר בית השחי כדי למנוע יצירת גרורות דרך מערכת הלימפה. בתום ניתוח משמר מומלץ טיפול קרינתי מקומי המיועד להרוג תאי סרטן המצויים בשד אך עזבו את הגידול העיקרי. ניתוחים שמרניים ניתן לבצע רק בחולות שלב 1 ו-2, או בחולות שלב 3 שהגיבו בצורה טובה לטיפול המקדים.
- כריתת רביע (quadrantectomy) - כריתה חלקית המתבססת על חלוקת השד לרביעים. לאחר שבביופסיה של אזורים שונים של השד נמצא שהתאים הסרטניים נמצאים רק ברביע מסוים, מוצא הרביע הנגוע ואיתו העור והפטמה המכסה אותו, וכן החיתולית שעליה הרביע מונח.
- כריתת גוש (lumpectomy) - ניתוח משמר בו נכרת הגוש הסרטני יחד עם רקמה בריאה בעובי 2 סנטימטר מסביבו.
מחקרים קליניים בהשתתפות אלפי חולות הוכיחו כי אין יתרון משמעותי לניתוח רדיקלי על פני ניתוח שמרני כל עוד ניתן להוציא את כל הגידול הממאיר ואת כל בלוטות הלימפה הנגועות. ניתוח משמר אינו מומלץ במקרים בהם:
- הגידול גדול – 5 סנטימטר (T3)
- השד קטן
- הגידול נמצא בפטמה או האריאולה
- לגידול מספר מוקדים הממוקמים ברבעונים שונים בשד
- האישה בעלת נטייה גנטית לסרטן השד
- לחולה היסטוריה של מחלות כלי דם תלויות קולגן
- החולה מנועה מסיבה כלשהי לעבור טיפול קרינתי
- האישה אינה מעוניינת בשימור השד (לרוב נשים מבוגרות).
מתוך כלל הנשים העוברות בארצות הברית ניתוח כריתת שד רדיקלי, רק כרבע נמצאות בקבוצות המנועות מניתוח משמר - כלומר, רוב הנשים העוברות ניתוח רדיקלי עושות זאת ללא סיבה רפואית מוצדקת, והיו יכולות להסתפק בניתוח משמר. נשים שעברו ניתוח משמר חשופות לחזרה מקומית של המחלה (גידול סרטני נוסף באותו השד), אך הן אינן נמצאות בסיכון גדול יותר לפיתוח גרורות מרוחקות לעומת נשים שעברו ניתוח רדיקלי.
טיפול כימותרפי
טיפול משלים
שימוש בטיפול משלים, היינו טיפול כימותרפי כלל-מערכתי המתבצע אחרי ניתוח לכריתת הגידול הראשוני, מקטין את הסיכוי לחזרת המחלה על ידי הריגת מיקרו-גרורות שיצאו מן הגידול הראשוני. בכך קטן הסיכוי לחזרה מקומית של הגידול במקרה של ניתוח שמרני, וניתן למנוע כשליש ממקרי החזרה של סרטן השד. הטיפול הכימותרפי המקובל כיום לנשים שנתגלה אצלן סרטן השד בשלביו הראשונים הוא תערובת של cyclophosphamide, adriamycine, ו-fluorouracil או בקיצור CAF.
כאשר החולה סובלת ממחלות לב, מומלץ להחליף את ה-adriamycine ב-methotrexate תערובת CMF, למרות שפרוטוקול זה הינו בעל יעילות אנטי-סרטנית נמוכה במקצת ביחס לטיפול CAF רגיל.
משפחת תרופות שנכנסה לשימוש בשנים האחרונות היא הטקסנים, paclitaxel ו-docetaxel המשמשים במקרה שיש מעורבות של בלוטות הלימפה.
הזמן הכולל לטיפול כימותרפי משלים הוא לרוב 3-6 חודשים. הוספת טקסנים מאריכה את זמן הטיפול ב-6 חודשים נוספים. ניתן להימנע מטיפול כימותרפי בנשים בעלות גידול קטן ללא מעורבות בלוטות הלימפה, בעלות רצפטור לאסטרוגן ובעלות תאים ממוינים היסטולוגית.
ניתן להעריך את התועלת שבטיפולים שונים על ידי תוכנת Adjuvant Online [1] המחשבת (על פי ניסויים קליניים מרובי משתתפים) את הסיכוי לחזרת המחלה, מוות מגורמים אחרים ואת התועלת שבשימוש בתוכניות טיפול משלים שונות בתום 5 שנים מאבחון המחלה. התוכנה משקללת קריטריונים אינדיבידואליים שונים של החולה כגון גודל הגידול, אופי היסטולוגי, קולטנים לאסטרוגן, גיל ועוד. למרות שהתוכנה משקללת תוצאות מניסויים רבים, חסרים בה קריטריונים מסוימים העוזרים לרופא לקבוע את תוכנית הטיפול המתאימה ביותר לחולה.
טיפול מקדים (נאו אג'וונט)
גישה טיפולית חדשה יחסית היא מתן טיפול כימותרפי לפני הניתוח להוצאת הגוש הסרטני. היתרון שבגישה זאת הוא שבאמצעות הקטנה של הגידול לפני הניתוח, הניתוח הנדרש יכול להיות שמרני יותר. בנשים בהן הגידול גדול במיוחד, או חודר את גבולות השד אל תוך בית החזה כך שלא ניתן להוציא את הגידול בשלמותו, טיפול כימותרפי מקדים יכול להקטין את ממדי הגוש ולהפוך את הוצאת הגידול בניתוח לאפשרית. יתרון נוסף של הטיפול הכימותרפי המקדים הוא האפשרות לבחון את רגישות הגידול לתוכנית טיפול הכימותרפי הניתן. כיוון שגידולם סרטניים שונים מגיבים באופן שונה לתוכניות טיפול שונות, בגישת הטיפול המקדים ניתן למצוא את התוכנית היעילה ביותר.
טיפול על ידי נוגדנים
בשנים האחרונות פותחו תרופות אחדות המורכבות מנוגדנים ספציפיים כנגד אנטיגנים המעורבים בתהליך הסרטני. בסרטן השד, הנוגדן היחיד שאושר לשימוש משלים הוא הרצפטין, הניתן במקביל לטיפול הכימותרפי.
טיפול אנדוקריני (הורמונלי)
טיפול אנדוקריני (הורמונלי) הוא הטיפול המשלים הנפוץ והיעיל ביותר בחולות בשלבים מוקדמים של המחלה (שלב 1 ו-2). הטיפול מקובל גם בשלבים מאוחרים יותר של סרטן השד, אך יעילותו בהם נמוכה יותר. שכיחות הטיפול האנדוקריני נובעת מהעדר תופעות לוואי חמורות המאפיינות את הטיפול הכימותרפי. ככלל, הטיפול האנדוקריני מבוסס על נטרול ההורמון הנקבי אסטרוגן, כיוון שהורמון זה מהווה פקטור גדילה לתאי האפיתל של השד, שמהם נוצרים תאי סרטן השד. הטיפולים האנדוקרינים יעילים בעיקר בחולות סרטן השד המבטאות קולטנים (רצפטורים) לאסטרוגן או פרוגסטרון. בחולות המבטאות את שתי הקולטנים ההיענות לטיפול היא כ-70%, בחולות המבטאות רצפטור אחד ההיענות לטיפול היא כ-30%, בחולות בהן לא נמצאו רצפטורים אחוז ההיענות הוא כ-10%. בנוסף, הטיפול האנדוקריני יכול לשמש גם כטיפול מניעתי (פרופילקטי) בנשים הנמצאות בסיכון גבוה לפיתוח סרטן השד או השחלה.
הבחירה בסוג הטיפול האנדוקריני מבוססת על הבדלים בעלות הטיפול ועל תופעות הלוואי שהיא משרה. חולות שהגיבו לטיפול אנדוקריני אחד הן בעלות סיכוי גבוה לתגובה טובה לטיפול אנדוקריני אחר. לעומת זאת, לא נמצאה תועלת בשימוש בתרופות אנדוקריניות שונות בו זמנית.
הורמונים אנלוגים להורמוני המין הנקביים
הורמונים אנלוגים להורמוני מין ובראשם טמוקסיפן הם התרופות הנפוצות ביותר לטיפול בסרטן השד. תרופות אלו מבוססות על קישור הורמון סינתטי לרצפטור לאסטרוגן, ובכך חסימת הקישור בין אסטרוגן לרצפטור. בניגוד לאסטרוגן, ההורמון האנלוגי אינו משרה על האסטרוגן רצפטור שינוי מרחבי, ולכן אינו מאפשר לו לפעול כגורם שעתוק, כלומר חוסם את הרצפטור ולא מפעיל אותו.
מעכבי ארומטז
מעכבי ארומטז הם תרופות המונעות יצירת אסטרוגן אנדוגני, על ידי עיכוב האנזים היוצר את הטבעות הארומטיות בהורמון זה, כלומר הן מונעות סינתזה של אסטרוגן בגוף.
תרופות מעכבות ארומטז הוכחו כיעילות יותר, הן במניעת חזרה של סרטן השד והן בשליטה על מחלה גרורתית. בנוסף, למעכבי ארומטז תופעות לוואי קלות יותר מאלו של תמוקסיפן. מסיבות אלו, מעכבי ארומטז הם הטיפול הטוב ביותר בכל חולות סרטן השד. ברם, מכיוון שמעכבי ארומטז הן תרופות חדשות באופן יחסי - טרם פג הפטנט עליהן, ולכן עלותן גבוהה באופן ניכר מטמוקסיפן. בשל עלותן הגבוהה של התרופות הן משמשות בעיקר לטיפול בחולות בשלבים מתקדמים של המחלה.
כריתת שחלות
כריתת שחלות היא הליך כירורגי המבוצע בחולות לפני גיל האל-וסת ונועד למנוע מהן יצור הורמוני מין. הליך זה היה מקובל בעבר, אך כיום הוא משמש במקרים נדירים בלבד.
חזרה מקומית של המחלה
חזרה מקומית של הגידול על דופן בית החזה בנשים שעברו ניתוח לכריתת שד, היא תופעה המקיפה כ-8% מן החולות. חזרה זאת מושפעת בעיקר מגודל הגידול המקורי וממעורבות של נודיות הלימפה. חזרה מקומית מבודדת יכולה להיות מטופלת בניתוח או הקרנות מקומיות. אם החזרה מרובת מוקדים, יש להקרין את כל דופן בית החזה ואת אזור בית השחי, ובנוסף יש לטפל צורך בטיפול כימותרפי. חזרה מקומית אחרי ניתוח רדיקלי יכולה להיות סימן לחזרה גרורתית של המחלה, ומחייבת חיפוש גרורות בעזרת CT. ברוב המקרים מתגלות גרורות עד שנתיים מגילוי חזרה מקומית רבת מוקדים.
טיפול בחולים גרורתיים
חולות סרטן השד בשלב 4 או שלב 3b מטופלות לרוב טיפול מקל – טיפול שאינו מיועד לריפוי המחלה, אלא להארכת חיים ולהפחתת סבלה של החולה. ברוב במקרים ניתן טיפול יחיד, ורק לאחר כישלונו מתחיל טיפול אחר. טיפולים אלו כוללים:
- הקרנה, באמצעות רדיותרפיה, לגידול הראשוני בשד ואיברים בהם מתפתחות הגרורות. ההקרנה יעילה במיוחד בהתמודדות עם גרורות יחידות בעצמות, בבית החזה, ובמערכת העצבים המרכזית.
- טיפול הורמונלי — נשים שקבלו בעבר טמוקסיפן ופיתחו חסינות אליו יכולות להפיק תועלת ממעכבי ארומטזות, כריתת שחלות, טיפול בטוסטסטרון, אסטרוגן, GnRH והורמונים נוספים.
- ביפוספנט (bisphosphonate) - נשים עם גרורות בעצמות יכולות להפיק תועלת מטיפול זה.
- טיפול בנוגדנים: הרצפטין - נוגדן נגד HER-2 - הוכח כיעיל בטיפול בסרטן השד, ניסויים קליניים שטרם הסתיימו מראים שגם לאווסטין פעילות אנטי סרטנית במחלה גרורתית של סרטן השד. הטיפול בנוגדנים ניתן בשילוב עם טיפול כמותרפי.
- טיפול כימותרפי בחולות גרורתיות משמש לרוב לאחר כישלון הטיפול ההורמונלי (כולל חולות חסרות רצפטור לאסטרוגן) או לאחר יצירת גרורות במוח או בריאות. הטיפול המועדף הוא תערובת המכילה doxorubicin וcyclophosphamide. בנוסף יש השפעה ל vincristine, methotrexate, fluorouracil, ו taxanes. אין השפעה לטיפול משלים קודם על תגובה לטיפול כימותרפי בשלב הגרורתי.
- טיפולים לשיקום המערכת החיסונית — הטיפולים הכימותרפיים הקשים אותן עוברות חולות סרטן השד יוצרות אנמיה ובעיות חמורות במערכת החיסון (neutropenia) עקב פגיעה בתאי הגזע היוצרים את תאי הדם השונים. לטיפול בבעיות אלו ניתנים ציטוקינים ופקטורי גדילה שונים המעודדים פרוליפרציה של תאי דם כגון G-CSF ו-erythropoietin. טיפולים אלו מקטינים את הסיכוי לזיהומים ובכך מאפשרים המשך השימוש בתרופות כימותרפיות.
- השתלת מח עצם — על פי פרוטוקול טיפול שנוי במחלוקת המתאים רק לחולות צעירות הנמצאות במצב בריאותי טוב במיוחד. ניתן לתקוף את הגידול במינונים גדולים מאוד של כימותרפיה, מינון שגם ישמיד את מח העצם. לאחר טיפול זה תעבור החולה השתלת מח עצם עצמית (אוטולוגית) לשיקום מערכת החיסון והדם. טיפול זה יקר מאוד, מסוכן ומתאים למעט מאוד חולות.
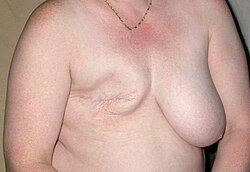
בנייה מחדש של השד
בנייה מחדש של השד או שחזור שד הוא ניתוח פלסטי המיועד למניעת המשבר הפסיכולוגי הנוצר כתוצאה מהניתוח להוצאת הגידול הראשוני. ניתן לשחזר שד שעבר ניתוח רדיקלי או שמרני. שיחזור השד מתבצע במסגרת ניתוח הכריתה, או כניתוח נפרד. בנייה מחדש של השד נעשית, לרוב, בדרך של החדרת פרוטזה של ג'ל סיליקון (שנאסרה לשימוש בניתוחים קוסמטיים רגילים), או סלין או רקמת שומן ושריר עצמית בין שרירי הפקטורליס הקטנים (pectoralis minor) לשרירי הפקטורליס הגדולים (pectoralis major).
הניתוח אינו פוגע באבחון של חזרת המחלה, אך הוא עלול ליצור בעיות מסוימות כגון הגברת הסיכוי למחלות אוטואימוניות ובעיות אחרות הנוצרות בניתוחי שד קוסמטיים.
מעקב
חולות סרטן השד שעברו את הטיפול הראשוני, חייבות להיות תחת מעקב רפואי למשך שארית חייהן. זאת במטרה לגלות, מוקדם ככול האפשר, חזרה מקומית (כ-8% כלל החולות) או גרורתית (35%-45% מכלל החולות שאובחנו ללא גרורות) של המחלה, או לאתר גידול ראשוני בשד השני (הסיכוי הוא כ- 20%-25%). חזרות גרורתיות ומקומיות מתרחשות לרוב בתוך 2-5 שנים, אך ייתכנו גם אחרי 15 שנה. ב-5 השנים הראשונות שאחר גילוי המחלה יש לעקוב אחר החולה במרווחים של חצי שנה, ולאחר 5 שנים מקובל יותר מעקב שנתי. פרט למעקב הרפואי, מומלץ לנשים אלו לבצע בדיקה עצמית אחת לחודש.
למרות שאין בנושא הוראות חד-משמעיות, ממליצים רוב האונקולוגים לנשים שעברו טיפול לסרטן השד שלא להיכנס להריון. הסיבה לכך היא שהשלייה מפרישה אסטרוגן, המאיץ את גידול התאים הסרטניים. לכן גם עדיף לחולות שלא ליטול טיפול הורמונלי חילופי לטיפול בבעיות גיל האל-וסת, (לא מדובר בטיפול הורמונלי אנטי-סרטני), כיוון שתרופות אלו מכילות גם הן אסטרוגן.
סוגים נדירים של סרטן השד
סרטן השד מסוג קרצינומה בנשים מהווה מעל 90% ממקרי סרטן השד. פרט לסרטן זה, קיימים מספר סוגים נדירים של סרטן השד:
- סרטן השד בגברים
- סרקומה של השד
- לימפומה של השד
- סרטן שד דלקתי - סרטן מסוג קרצינומה עם מעורבות המערכת החיסונית
ראו גם
קישורים חיצוניים
- האגודה הישראלית למלחמה בסרטן
- אחת מתשע
- האיגוד הישראלי לאונקולוגיה ורדיותרפיה
- החברה הישראלית לגינקולוגיה אונקולוגית
- החברה לרפואת נשים בקהילה
- רב-שיח, סרטן השד, הערוץ האקדמי של אוניברסיטת חיפה, 05/11/2007